Ⅲ章 資料
- A 臨床研究としての
治療法の解説 - B 生検組織診断分類
(Group 分類)の取扱い - C 文献
臨床研究としての治療法の解説
以下の治療法は,日常診療として推奨されるには至っていないものの,有望な治療法として期待されており,臨床研究として前向きデータ集積が行われることが望ましい。これらの治療を行う場合は,あらかじめ患者にその理由を説明し,十分な理解を得たのち同意を得ることが望ましい。
早期胃癌に対する ESD(拡大適応)
早期胃癌外科手術例の他病死を除いた 5年生存率は,pT1a で99.3%,pT1b で96.7%と報告されており[1],予想されるリンパ節転移率が pT1a で約1%,pT1b で約3%以下であれば内視鏡切除で外科手術と同等の治療成績が得られる可能性がある。外科切除例のリンパ節転移の検討[2,3]より(表 4), ① 分化型,pT1a,UL(-),2cm以上, ② 分化型,pT1a,UL(+),3cm以下, ③ 2cm以下の pT1a,UL(-)の未分化型癌(いずれも脈管侵襲陰性),が適応拡大病変とされている(表 4の黄色部分)。また,切除後の病理診断にて, ④ 分化型,pT1b,3cm以下,の場合にも経過観察可能としている。病変は一括切除することが原則であるため,切除法としては ESD が必要である。
ESD 適応拡大病変の標準治療は,外科的胃切除である。しかし外科切除後には小胃症状による QOL の低下が必発であるが,ESD は粘膜下層までの切除であり,治療前とほぼ同様の生活を送ることができる。患者の QOL の点からみると明らかに ESD の方が優れている。生命予後に関して,適応拡大 ESD が外科切除と同等以上の成績が得られるならば,今後標準治療が ESD となり得る。しかし現時点においては,適応拡大 ESD が生命予後と安全性に関して外科切除成績と同等の成績が得られるという十分なエビデンスに乏しいため,臨床試験として行われるべき,との位置づけである。
外科切除例におけるリンパ節転移の解析[2,3]から,適応拡大病変のリンパ節転移率が外科切除による 5年間の原病死よりも低い可能性が示され,また後ろ向きの解析ではあるが長期予後がガイドライン適応病変と同等との結果が得られた[4]。現在,上記 ① , ② を対象とした前向き第2相試験(JCOG0607)が進行中である。本試験は,対象群に対して ESD を施行し,すべての死亡をイベントとした 5年生存割合が外科切除成績と同等であることを検証するための試験である。また, ③ に対しても前向き試験が計画中である。
表 4 外科切除例からみた早期胃癌のリンパ節転移頻度(国立がん研究センター中央病院) 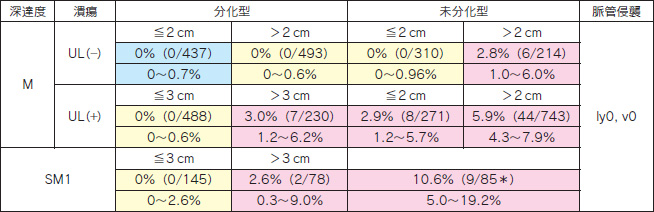 上段:リンパ節転移率,下段:95%信頼区間
上段:リンパ節転移率,下段:95%信頼区間
| [1] | 笹子三津留,木下 平,丸山圭一:早期胃癌の予後.胃と腸 1983; 28: 139-46. |
|---|---|
| [2] | Gotoda T, Yanagisawa A, Sasako M, et al: Incidence of lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large centers. Gastric Cancer 2000; 3: 219-25. |
| [3] | Hirasawa T, Gotoda T, Miyata S, et al: Incidence of lymph node metastasis and the feasibility of endoscopic resection for undifferentiated-type early gastric cancer. Gastric Cancer 2009; 12: 148-52. |
| [4] | 草野 央,後藤田卓志,岩崎 基,他:早期胃癌に対する内視鏡的切除後の長期予後.胃と腸 2008; 43: 74-80. |
腹腔鏡下胃切除術
低侵襲治療への期待と関心が高まる中で発展してきた内視鏡外科手術は胃癌治療に対しても多くの施設で施行されるようになってきている。2007年の厚生労働省統計表データベースならびに日本内視鏡外科学会アンケート調査[1]によると胃癌手術の中の約20%の症例に腹腔鏡下胃切除術が適用されている。しかしながら胃癌に対する腹腔鏡下胃切除術と開腹胃切除術の比較検討については十分な症例数を対象にした無作為化比較試験はこれまで報告されておらず,症例数の少ない比較試験の報告が数編[2,3]あるに過ぎない。それらの結果では,術中出血量や呼吸機能障害,術後鎮痛剤投与量,在院日数などの指標が低侵襲治療としての腹腔鏡下手術の有用性を一様に示唆しているものの,エビデンスレベルの高い立証はない[4]。そうしたことから,ガイドライン第2版では日常診療としてではなく病期 IA,IB に適応する臨床研究の一方法として位置づけられ,今般の第3版においても臨床研究としての治療法のままである。また,2008年9月に出版された「日本内視鏡外科学会診療ガイドライン」においても胃癌に対する腹腔鏡下手術の推奨度は現状“C”(十分なエビデンスがない)とされている。そこで,有用性の検証を目的にわが国において種々の臨床試験が行われ,また企画されている。すなわち,日本臨床腫瘍研究グループ(JCOG)において T2N0 までを対象にして縫合不全と膵液瘻を主評価項目にした第2相試験 JCOG0703[5]の症例登録が 2008年に終了し,十分な経験をもつ施設における安全性が示された。現在,腹腔鏡下手術と開腹手術の第3相比較試験が JCOG ならびに腹腔鏡下胃切除研究会において開始される状況にある。腹腔鏡下胃癌手術の客観的評価ならびに普及のためにはエビデンスの構築が何よりも重要であり,こうした臨床試験の今後の展開が期待されている。
| [1] | 内視鏡外科手術に関するアンケート調査―第 9 回集計結果報告.日鏡外会誌 2008; 13: 500-604. |
|---|---|
| [2] | Huscher CG, Mingoli A, Sgarzini G, et al: Laparoscopic versus open subtotal gastrectomy for distal gastric cancer: five-year results of a randomized prospective trial. Ann Surg 2005; 241: 2132-237. |
| [3] |
Kitano S, Shiraishi N, Fujii K, et al: A randomized controlled trial comparing open vs laparoscopy-assisted distal gastrectomy for the treatment of early gastric cancer: an interim report. Surgery 2002; 131(1 Suppl): S306-11. |
| [4] | Memon MA, Khan S, Yanus RN, et al: Meta-analysis of laparoscopic and open distal gastrectomy for gastric carcinoma. Surg Endosc 2008; 22: 1781-9. |
| [5] |
Kurokawa Y, Katai H, Fukuda H, et al: Phase Ⅱ study of laparoscopy-assisted distal gastrectomy with nodal dissection for clinical stage Ⅰ gastric cacer: Japan Clinical Oncology Group Study JCOG0703. Jpn J Clin Oncol 2008; 38: 501-3. |
胃局所切除術
EMR・ESD などの内視鏡治療と定型的胃切除術の中間に位置づけられる手術法である。胃局所切除術では胃は楔状に切除される。内視鏡的治療の適応外症例では胃が広範囲に切除されるが,その差が大きいために,リンパ節転移の可能性がほぼない粘膜内癌を対象として開発された手法である[1]。腫瘍近傍のリンパ節も郭清することが可能であり,腹腔鏡手術導入後は,より低侵襲な治療として評価された。胃局所切除術では,切除範囲が大きくなると胃の変形も大きくなることから,腫瘍径は4cmまでが適応とされている。胃が残ることのメリットは大きいが,ESD の普及で内視鏡的切除術と適応が重なるようになり,日常的に行われることは少なくなった。高齢,全身状態不良などの症例,患者の希望がある場合などに考慮される。しかしながら,QOL 維持においては優れた手術法であり[2],今後の診断技術の進歩(sentinel node など)に伴う標準手術の変化によっては,再評価される可能性がある。
| [1] | Ohgami M, Otani Y, Kumai K, et al: Curative laparoscopic surgery for early gastric cancer: five years experience. World J Surg 1999; 23: 187-93. |
|---|---|
| [2] | Seto Y, Yamaguchi H, Shimoyama S, et al: Results of local resection with lymphadenectomy for early gastric cancer. Am J Surg 2001: 182; 498-501. |
術前補助化学療法
術前化学療法は再発の一要因となる微小転移の消滅を図り,その後遺残した原発巣や転移巣を切除する集学的治療である。術後化学療法に比べ,より強力な化学療法が施行可能であるため奏効率が高率であり,ダウンステージによる切除率の向上や腫瘍の縮小による他臓器合併切除の回避などが期待される。一方,化学療法に感受性がない場合は,病変がさらに進行し手術時機を逸する危険性がある。また,化学療法による組織の脆弱化や骨髄抑制による術後合併症の増加,経済的な負担の増加や告知後手術までの待機期間延長による精神的苦痛の増加などのデメリットもある。
pCR 率は依然として低いが,安全性が確認されており,ダウンステージ,R0 切除率の向上など近接効果は評価されている[1]。奏効例の生存率向上が指摘されているが,明らかな全生存率の改善効果を認めたというエビデンスがないため,日常診療としては未だ奨励されていない。現在,大型3型および4型胃癌を対象とする第3相試験がわが国で進行中である(JCOG0501)。
臨床研究として行う場合は,以下のような症例が対象としてあげられる。
| ① | 手術単独でも治癒切除を達成できるが,再発の危険の比較的高い症例:微小転移のコントロールを目的とする。具体的な適応条件は cStage ⅢA-ⅢC(cT4,cN1-2,P0,H0)である。 |
|---|---|
| ② | R0/R1 切除が可能でも予後が不良な症例:高度リンパ節転移を有する[2],または大型3型,4型胃癌などの高度進行癌で,ダウンステージを目的とする。 |
| [1] | Cunningham D, Allum WH, Stenning SP, et al: Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006; 355: 11-20. |
|---|---|
| [2] | Yoshikawa T, Sasako M, Yamamoto S, et al: Phase Ⅱ study of neoadjuvant chemotherapy and extended surgery for locally advanced gastric cancer. Br J Surg 2009; 96: 1015-22, Epub. |
S-1 以外の術後補助化学療法
治癒切除後の微小遺残腫瘍による再発予防を目的として術後補助化学療法が実施される。海外では米国において術後の 5-FU/ロイコボリン+放射線照射の有効性が(INT0116 試験)[1],また,英国では ECF(エピルビシン+シスプラチン+ 5-FU)療法による術前・術後補助化学療法の有効性が証明されているものの(MAGIC 試験)[2],いずれの試験も全体の治療成績が日本に比べて劣ること,日本で標準治療とされている D2 郭清の実施率が低いこと,MAGIC 試験においては化学療法の完遂率が低いことなどから,これらの試験結果を国内の実地臨床にそのまま適用することは妥当でない。
一方,日本国内で,ACTS-GC 試験以外に手術単独を対照としたランダム化比較試験で評価され,有効性が示唆された術後補助化学療法の成績は,N・SAS-GC(高用量 UFT の16カ月間投与)以外に殆ど存在しない[3]。N・SAS-GC 試験では,症例数が190例と当初の予定に到達していないにもかかわらず,予想を上回る UFT の有効性が示された(ハザード比 0.46)。症例数の問題や,対象が T2/N1-2 と限定的であったことなどから,S-1 のように Stage Ⅱ,Ⅲにわたって適用可能な標準治療とはいえず,S-1 が使用できない場合の治療オプションとしての位置づけに留まると考えられる。
ACTS-GC 試験の S-1 単独療法群においては,血行性転移の制御が十分でないこと,Stage ⅢA,ⅢB の 3年生存率がそれぞれ76.2%,64.2%と改善の余地があることが今後の臨床研究の課題である。
| [1] |
Macdonald JS, Smalley SR, Benedetti J, et al: Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med 2001; 345: 725-30. |
|---|---|
| [2] | Cunningham D, Allum WH, Stenning SP, et al: Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006; 355: 11-20. |
| [3] |
Nakajima T, Kinoshita T, Nashimoto A, et al: Randomized controlled trial of adjuvant uracil-tegafur versus surgery alone for serosa-negative, locally advanced gastric cancer. Br J Surg 2007; 94: 1468-76. |
術前化学放射線療法
欧米で臨床試験が行われているが,わが国ではごく一部の施設で臨床研究が行われているのみであり,日常臨床で推奨するに足るエビデンスはない。欧州では主に噴門部および下部食道腺癌を対象とした臨床試験が行われ,米国では胃癌を対象とした第2相試験が報告されている。後者では,高い病理学的 pCR 率(20~30%)が報告されているが[1],ランダム化比較試験は現在まで行われていない。
臨床研究としては,cStage Ⅱ-Ⅳ(M0)が対象となる。P0/CY0 を腹腔鏡で確認する必要がある。
| [1] |
Ajani, JA, Winter K, Okawara GS, et al: Phase Ⅱ trial of preoperative chemoradiation in patients with localized gastric adenocarcinoma(RTOG9904): quality of combined modality therapy and pathologic response. J Clin Oncol 2006; 24: 3953-8. |
|---|
術後化学放射線療法
米国では MacDonald らの報告[1]以来,治癒切除後の化学放射線療法が標準治療となり,現在,化学療法レジメン部分を比較するランダム化試験が進行中である。しかしこれは,D0/D1 郭清が主体で放射線治療施設が充実している米国での標準であり,D2 郭清による局所制御が確立しているわが国での放射線治療のエビデンスはなく,日常臨床で推奨できるレベルにはない。現在韓国で,D2 郭清手術症例でカペシタビン+シスプラチン補助化学療法群を対照とした単施設ランダム化比較試験(ARTIST 試験)が進行中である。
| [1] |
Macdonald JS, Smalley SR, Benedetti J, et al: Chemotherapy after surgery compared with sur-gery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med 2001; 345: 725-30. |
|---|
減量手術〔ⅡB-1-b:非治癒手術の項を参照〕
治癒切除が困難な症例において,外科的切除により体内に残存する腫瘍量を減少させて予後の延長を図ろうとする治療法を減量手術という。後ろ向きの臨床研究では,非切除症例に比較し非治癒切除症例の予後が良好であるとの報告が散見されるが,これらは症例選択バイアスが大きいこと,また近年化学療法の発達による生存期間の延長がみられることから,減量手術の意義は不明である。これまでの研究報告では,非治癒因子が2因子以上ある場合には1因子に比較して胃切除後の予後の延長がないことが一般的に知られており[1],非治癒因子が1因子の場合が減量手術の適応とされている。
減量手術の意義を明らかにする目的で,治癒切除不能の肝転移(H1),腹膜播種(P1),もしくは No.16a1/b2 に及ぶ大動脈周囲リンパ節転移(M1)のいずれか1つを有する Stage Ⅳ胃癌患者に対して,S-1 +シスプラチンによる化学療法単独群を対照治療,D1 胃切除と S-1 +シスプラチンによる術後化学療法を試験治療とする第3相比較試験が2008年2月から日韓共同で行われている(JCOG 0705/REGATTA 試験)。
| [1] | Hartgrink HH, Putter H, Kranenbarg EK, et al: Value of palliative resection in gastric cancer. Br J Surg 2002; 89: 1438-43. |
|---|